2017년06월24일 10번
[과목 구분 없음] 다음은 3가지 분자의 분자식이다. [BF3, CH4, NH3] 분자의 결합각 크기를 비교한 것으로 옳은 것은?
- ① BF3> CH4> NH3
- ② BF3> NH3> CH4
- ③ CH4> NH3> BF3
- ④ NH3> BF3> CH4
(정답률: 알수없음)
문제 해설
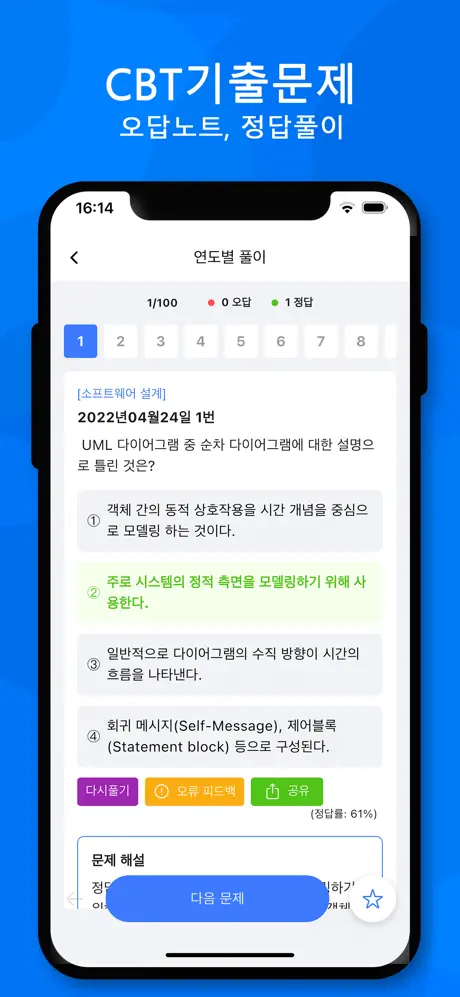
BF3는 삼각평면 구조를 가지며, 결합각은 120도입니다. CH4는 탄소 원자가 중심이 되어 사면체 구조를 가지며, 결합각은 109.5도입니다. NH3는 질소 원자가 중심이 되어 삼각피라미드 구조를 가지며, 결합각은 107도입니다.
따라서, 결합각이 가장 큰 것은 BF3이고, 그 다음으로 CH4이며, NH3이 가장 작습니다. 이는 분자 구조와 전자 수에 따른 결합각의 차이로 설명할 수 있습니다.